วิวัฒนาการของตารางธาตุ
ตารางธาตุ
หมายถึง
ตารางที่นักวิทยาศาสตร์จัดทำขึ้นเพื่อรวบรวมธาตุต่าง ๆ
เอาไว้ด้วยกันให้เป็นหมวดหมู่เพื่อสะดวกในการศึกษา
ปี พ.ศ.2360 (ค.ศ.1817) โยฮันน์ เดอเบอไรเนอร์ (Johann Wolfgang
Dobereiner) นักเคมีคนแรกที่พยายามจัดธาตุเป็นกลุ่มๆ ละ 3 ธาตุ ตาสมบัติที่คล้ายคลึงกัน เรียกว่า
ชุดสาม (Triad) และพบว่า
ธาตุกลางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของอีกสองธาตุที่เหลือ
ตัวอย่างธาตุชุดสามของเดอเบอไรเนอร์ เช่น
Li มวลอะตอม = 7.0
Na มวลอะตอม = = 23
K มวลอะตอม = 39.1
แต่กฎนี้ใช้ได้กับธาตุบางหมู่เท่านั้น จึงไม่เป็นที่ยอมรับกัน
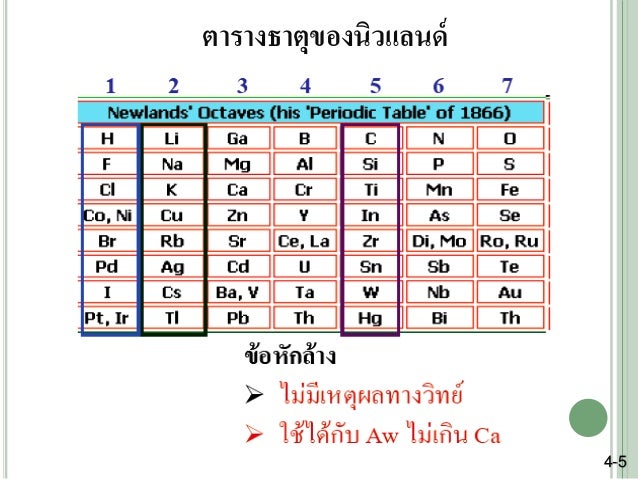
ปี พ.ศ. 2407 (ค.ศ.1864) จอห์น อเล็กซานเดอร์ รีนา นิวแลนด์ส (John Alexander
Reina Newlands) นักเคมีชาวอังกฤษพบว่าถ้านำธาตุมาเรียงตามมวลอะตอม จากน้อยไปมากแล้ว จะพบว่าธาตุที่ 8 จะมีสมบัติทางเคมีและกายภาพ คล้ายธาตุที่ 1 และจะเกิดขึ้นทุกๆ
ช่วงของธาตุที่ 8 เรียกการจัดนี้ว่า Law of Octaves กฎนี้ไม่เป็นที่ยอมรับ เนื่องจากไม่สามารถอธิบายได้ว่า มวลอะตอมกับสมบัติที่คล้ายกันของธาตุนั้นมีความสัมพันธ์กันอย่างไร และกฎนี้ใช้ได้ถึงแคลเซียม (Ca) ที่มีมวลอะตอม 40 เท่านั้น เช่น ธาตุที่ 8 คือ โซเดียม (Na) จะมีสมบัติคล้ายกับธาตุที่ 1 คือลิเทียม (Li ) และถ้านับต่อไปจากโซเดียม (Na) ไปอีก 8 ธาตุ ก็คือ โปแตสเซียม (K) ดังนั้น Li , Na , K จะอยู่ในกลุ่มเดียวกัน
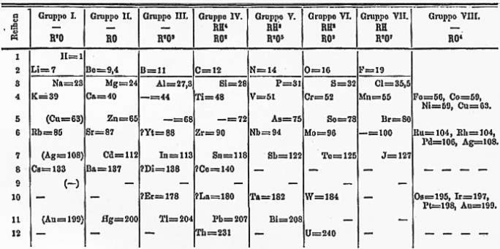
 กฏพิริออดิก กล่าวว่า ถ้าจัดเรียงธาตุตามมวลอะตอมของธาตุต่าง ๆ
จากน้อยไปมากธาตุที่มีสมบัติคล้ายกันจะปรากฎซ้ำกันและอยู่ตรงกันเป็นช่วง ๆ กฎ
กฏพิริออดิก กล่าวว่า ถ้าจัดเรียงธาตุตามมวลอะตอมของธาตุต่าง ๆ
จากน้อยไปมากธาตุที่มีสมบัติคล้ายกันจะปรากฎซ้ำกันและอยู่ตรงกันเป็นช่วง ๆ กฎ
จากกฎพิริออดิก เมนเดเลเอฟ จึงจัดตารางธาตุขึ้น เรียกว่า ตารางพิริออดิกของ เมนเดเลเอฟ
ต่อมาปีพ.ศ. 2546 (ค.ศ.1913) เฮนรี่ กวิน
เจฟฟรีส์ โมสลีย์ (Henry Gwyn Jeffreys Moseley) พบว่าการเรียงธาตุตามเลขอะตอม (จำนวนโปรตอนหรืออิเล็กตรอน) จะสอดคล้องกับกฎพิริออดิกโดยไม่ต้องสลับที่ธาตุกันเหมือนการเรียงตามมวลอะตอม
และได้นำมาใช้การจัดตารางธาตุในปัจจุบัน

ตารางธาตุในปัจจุบัน
ปัจจุบันนักเคมีพบว่า สมบัติต่างๆ
ของธาตุมีความสัมพันธ์กับการจัดเรียงตัวของอิเล็กตรอนในอะตอมของธาตุนั้น ๆ นั่นคือ ถ้าเรียงธาตุตามเลขอะตอมจากน้อยไปหามาก
จะปรากฏธาตุที่มีสมบัติคล้ายคลึงกันซ้ำกันเป็นช่วงตามการจัดเรียงอิเล็กตรอนของธาตุเหล่านั้น ปัจจุบันจึงจัดเรียงธาตุในตารางธาตุตามเลขอะตอม
ตารางธาตุที่นิยมใช้ในปัจจุบันปรับปรุงมาจากตารางธาตุของเมนเดเลเอฟ
แต่เรียงธาตุตามลำดับเลขอะตอมจากซ้ายไปขวา โดยจัดธาตุออกเป็นหมู่และเป็นคาบ ดังรูป


ไม่มีความคิดเห็น:
แสดงความคิดเห็น