แรงยึดเหนี่ยวระหว่างโมเลกุล(เกิดเฉพาะในพันธะโคเวเลนต์ ใช้บอกจุดเดือด)
เมื่อโมเลกุลหลายๆ โมเลกุลอยู่รวมกันเป็นกลุ่มเป็นก้อนได้นั้น จะต้องมีแรงยึดเหนี่ยวระหว่างโมเลกุลซึ่งยึดแต่ละโมเลกุลเหล่านั้น ตัวอย่างเช่น น้ำในแก้วหนึ่งประกอบด้วยโมเลกุลของน้ำจำนวนมากโดยที่แต่ละโมเลกุลยึดเหนี่ยวกันในรูปของของเหลว เมื่อให้ความร้อนแรงยึดเหนี่ยวระหว่างโมเลกุลของน้ำก็จะถูกทำลาย และทำให้โมเลกุลของน้ำเป็นอิสระจากกันได้ จึงอยู่ในสถานะก๊าซ
แรงยึดเหนี่ยวระหว่างโมเลกุล แบ่งออกเป็น 3 ชนิด ดังนี้
1. แรงลอนดอน (ไม่มีขั้ว) เช่น F2(F-F F-F)
2. แรงดึงดูดระหว่างขั้ว เช่น FCl ( F-Cl F-Cl )
3. พันธะไฮโดรเจน เช่น H2O กับ H2O
| 1.โลหะโซเดียมที่อยู่ในสถานะของแข็งระเหิดกลายเป็นไอ (กลายเป็นอะตอมในสถานะก๊าซ) ขั้นนี้ต้องใช้พลังงาน หรือดูดพลังงานเท่ากับ 109 kJ/mol เรียกพลังงานที่ใช้ในขั้นนี้ว่าพลังงานการระเหิด (Heat of siblimation) สัญลักษณ์ " Hs" หรือ "S" Hs" หรือ "S"
Na(s)+ 109 kJ---------------->Na(g).........(1)
|
|
2.โมเลกุลของคลอรีน (Cl2(g)) ซึ่งอยู่ในสถานะก๊าซแตกตัวออกเป็นอะตอมในสถานะก๊าซ (Cl(g))
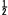 Cl Cl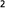 (g) + 242 kJ -------------------> 2Cl(g) (g) + 242 kJ -------------------> 2Cl(g)
แต่ในการเกิด NaCl(s) 1 mol ต้องใช้ Cl(g) เพียง 1 mol ดังนั้น
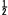 Cl2(g) +121 kJ-------------------->Cl(g).........(2) Cl2(g) +121 kJ-------------------->Cl(g).........(2)
ขั้นนี้ต้องใช้พลังงานหรือดูดพลังงานเท่ากับ 121 kJ เรียกพลังงานที่ใช้ในขั้นนี้ว่า พลังงานสลายพันธะ หรือพลังงานการแตกตัว (Bond Dissociation energy) สัญลักษณ์ " Hdis" หรือ "d" Hdis" หรือ "d"
|
| 3.อะตอมของโซเดียมในสถานะก๊าซ เสีย 1 เวเลนซ์อิเลคตรอน กลายเป็นโซเดียมไอออนในสถานะก๊าซ ขั้นนี้ต้องใช้พลังงานหรือดูดพลังงาน 494 kJ/mol เรียกพลังงานที่ใข้ในขั้นนี้ว่า พลังงานไอออไนเซชั่น(Ionization Energy) สัญลักษณ์ "IE" หรือ "I"
Na(g)+494 kJ----------------->Na (g) + e (g) + e .........(3) .........(3)
|
| 4.คลอรีนอะตอมในสถานะก๊าซรับอิเลคตรอนกลายเป็นคลอไรด์ไอออนในสถานะก๊าซ(Cl-(g)) ขั้นนี้คายพลังงานออกมา 347 kJ/mol พลังงานที่คายออกมาในขั้นนี้เรียกว่า อิเลคตรอนอัฟฟินิตีหรือสัมพรรคภาพอิเลคตรอน (Electron Affinity) สัญลักษณ์ E หรือ EA
Cl(g)+e- -----------------> Cl-(g)+347 kJ...........(4)
|
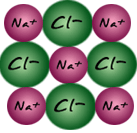
| 5.โซเดียมไอออนในสถานะก๊าซ และคลอไรด์ไอออนในสถานะก๊าซรวมตัวกันด้วยพันธะไอออนิกได้ผลึกโซเดียมครอไรด์ (NaCl(s)) ขั้นนี้คายพลังงานออกมา 787 kJ/mol พลังงานที่คายออกมาในขั้นนี้เรียกว่าพลังงานแลคทิซ หรือพลังงานโครงร่างผลึก (Lattic Energy) สัญลักษณ์ U หรือ Ec
Na+(g) + Cl-(g) ---------------------->NaCl(s)+787 kJ.........(5)
เมื่อเอาสมการ (1)+(2)+(3)+(4)+(5) จะได้สมการรวมหรือปฏิกิริยารวมดังนี้
Na(s)+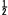 Cl Cl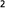 (g)-----------------------> NaCl(s)+410 kJ..........(6) (g)-----------------------> NaCl(s)+410 kJ..........(6)
แสดงว่าในการเกิด NaCl(s) เป็นการเปลี่ยนแปลงประเภทคายพลังงาน คือ เมื่อเกิด NaCl 1 mol จะคายพลังงานเท่ากับ 410 kJ
พลังงานที่คายออกมาเรียกว่า พลังงานของปฏิกิริยาหรือความร้อนของปฏิกิริยาหรือความร้อนของการเกิดสาร สัญลักษณ์ " Hf" Hf"
หมายเหตุ การเกิดสารประกอบไอออนิกอาจคายหรือดูดพลังงานก็ได้แต่มักจะคายพลังงาน
|
|


ไม่มีความคิดเห็น:
แสดงความคิดเห็น